Química 1o ano
Formulário teste 2
https://forms.gle/fZg5M4jKqhFLFrNJA
formulario teste
https://forms.gle/3XA8LLYtZpWeVQBQ7
https://forms.gle/mCjw7YmYwq6t3wRo8
4° bimestre
Atividade de química
Uso do livro Conexões - Ciências da natureza e suas tecnologias
Matéria e energia
Vale 1 ponto na média
Páginas 29, 30 e 31
Fazer em seu caderno uma sìntese (resumo) sobre os modelos atômicos de Dalton, Thomson, Rutherford e Rutherford-Bohr.
Responder as perguntas:
1-O que é uma lei ?
2-O que são hipóteses?
3-O que são teorias ?
4-O que é átomo ?
Como surgiram os elementos químicos?
A tabela periódica é composta por 114 elementos químicos bem conhecidos e caracterizados – e prestes a ganhar até o final deste ano (2016) a confirmação definitiva de mais 4 elementos químicos sintetizados artificialmente.
Mas… como surgiram todos esses elementos químicos?
Antes de tudo é bom ressaltar que os processos que envolvem o surgimento de elementos químicos não são reações químicas convencionais. São processos de fusão e fissão nuclear. Ou seja, processos em que átomos podem ser fundidos (fusão) ou divididos (fissão). De um modo geral tais eventos são conhecidos como nucleossíntese.
As nucleossínteses podem ser realizadas artificialmente pelo homem, por meio de reatores nucleares (de fissão ou fusão) ou em equipamentos destinados especificamente à nucleossíntese usando aceleração e colisão de partículas nucleares.
O primeiro processo de nucleossíntese natural foi o Big Bang, com uma produção massiva de elementos (e seus isótopos) químicos que estão ali no início da tabela periódica – hidrogênio e hélio. Tendo algum resquício de formação de lítio, berílio e boro. Sendo esses últimos 3 elementos com quantidade mais significativa em processos de fragmentação de elementos mais pesados pela ação de raios cósmicos durante os bilhões de anos de existência do Universo.
Elementos a partir do carbono podem ser formados em processos que ocorrem em estrelas. Seguindo pela tabela periódica; alguns elementos podem ser formados em estrelas não muito maiores do que o nosso Sol, enquanto que outros elementos com mais prótons e nêutrons precisam de condições mais drásticas, encontradas em estrelas mais massivas.
E o show final fica por conta da explosão de estrelas – Supernovas – que possuem massas maiores do que 10 vezes o nosso Sol. Com a possibilidade de dar vazão a vários processos nucleares de alta energia com a criação de diversos elementos presentes na tabela periódica.
Pesquise para responder, faça em seu caderno vale 1,5 ponto na média.
1- O que é fusão nuclear ?
2- O que é fissão nuclear ?
3- O que é nucleossíntese ?
4- O que são isótopos ? Dê exemplos.
5- Explique com suas palavras como se formam os elementos químicos.
Transformações da matéria e calor
Reações endotérmicas e exotérmicas
2o BIMESTRE Química
Os temas para Feira Cultural
Tema 1 - O que são isótopos ?
Tema 2 - Os isótopos do carbono . Qual a utilização do carbono 14
Tema 3 - O hidrogênio e seus isótopos
Tema 4 - A radioatividade e o isótopo césio 137
Tema 5 -A ligação iônica e a formação dos compostos iônicos, e seu retículo cristalino (estrutura)
Tema 6 -A ligação molecular e a estrutura das moléculas
Tema 7 -A ligação metálica e suas ligas metálicas
Tema 8 - Oxidação da maçã - Por que ela escurece em contato com o ambiente ? Como retardar este processo ?
Tema 9 -Transformações da matéria fenômenos físicos e químicos
Orientações
Essa pesquisa servirá como nota da avaliação bimestral
Pesquisar sobre o tema para a realização da apresentação no dia 10/6. Utilizem cartaz, figura, imagens sobre o tema escolhido, usem a criatividade.
Dividam as tarefas entre os participantes do grupo, todos tem que participar.
Vocês terão que entregar até o dia 15/6 um relatório da atividade, anotem tudo o que foi realizado para ser entregue até a data (individual esse será o registro para nota, além da apresentação).
Dúvidas whtsapp 985551141
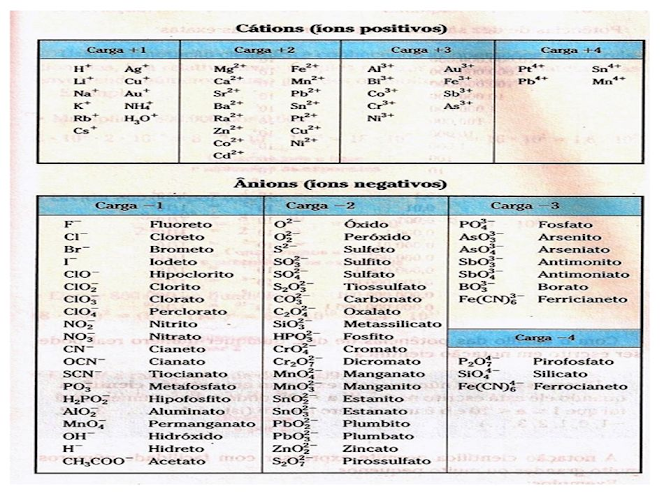
Pessoal postei aqui duas tabelas de cátions e ânions, logo abaixo. As duas apresentam os mesmos íons, utilizem a que estiver com melhor imagem.
Ligações químicas
Clique para assistir vídeo sobre ligações químicas
As ligações químicas correspondem à união dos átomos para a formação das substâncias químicas.
Em outras palavras, as ligações químicas acontecem quando os átomos dos elementos químicos se combinam uns com os outros e os principais tipos são:
- Ligações iônicas: transferência de elétrons;
- Ligações covalentes: compartilhamento de elétrons;
- Ligações metálicas: existência de elétrons livres.
Regra do Octeto
A Teoria do Octeto, criada por Gilbert Newton Lewis (1875-1946), químico estadunidense, e Walter Kossel (1888-1956), físico alemão, surgiu a partir da observação dos gases nobres e algumas características como, por exemplo, a estabilidade dos elementos que apresentam 8 elétrons na Camada de Valência.
Portanto, a Teoria ou Regra do Octeto explica a ocorrência das ligações químicas da seguinte forma:
“Muitos átomos apresentam estabilidade eletrônica quando possuem 8 elétrons na camada de valência (camada eletrônica mais externa).”
Para tanto, o átomo procura sua estabilidade doando ou compartilhando elétrons com outros átomos, donde surgem as ligações químicas.
Vale lembrar que existem muitas exceções à Regra do Octeto, principalmente entre os elementos de transição.
Saiba mais sobre a Teoria do Octeto.
Tipos de Ligações Químicas
Ligação Iônica
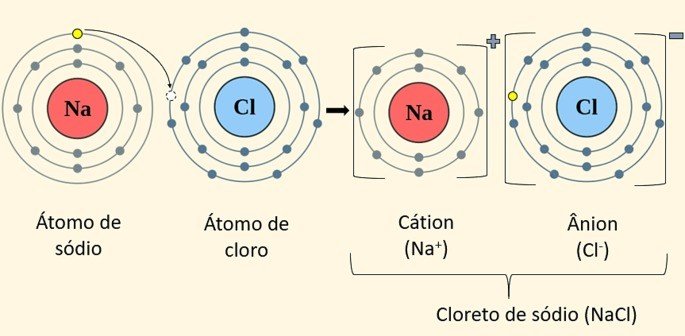
Também chamada de ligação eletrovalente, esse tipo de ligação é realizada entre íons (cátions e ânions), daí o termo "ligação iônica".
Para ocorrer uma ligação iônica os átomos envolvidos apresentam tendências opostas: um átomo deve ter a capacidade de perder elétrons enquanto o outro tende a recebê-los.
Portanto, um ânion, de carga negativa, se une com um cátion, de carga positiva, formando um composto iônico por meio da interação eletrostática existente entre eles.
Exemplo: Na+Cl- = NaCl (cloreto de sódio ou sal de cozinha). Nesse composto, o sódio (Na) doa um elétron para o cloro (Cl) e se torna um cátion (carga positiva), enquanto o cloro torna-se um ânion (carga negativa).
Outros exemplos de substâncias formadas por ligações iônicas são:
- Brometo de potássio, KBr
- Cloreto de cálcio, CaCl2
- Fluoreto de magnésio, MgF2
Os compostos iônicos geralmente são encontrados no estado sólido em condições ambientes e apresentam elevados pontos de fusão e ebulição. Quando dissolvidos em água, essas substâncias são capazes de conduzir corrente elétrica, já que seus íons são liberados em solução.
Saiba mais sobre a ligação iônica.
Ligação Covalente
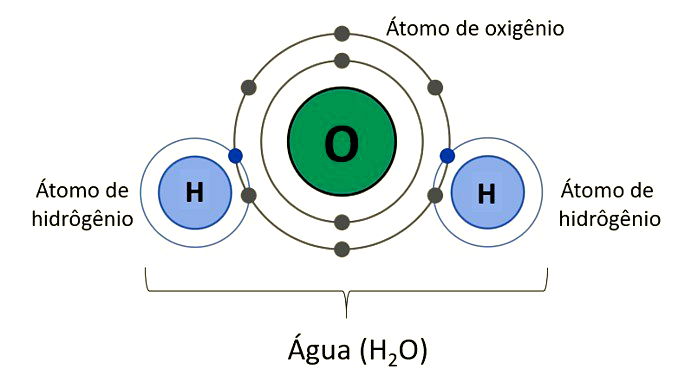
Também chamada de ligação molecular, as ligações covalentes são ligações em que ocorre o compartilhamento de elétrons para a formação de moléculas estáveis, segundo a Teoria do Octeto; diferentemente das ligações iônicas, em que há perda ou ganho de elétrons.
Além disso, pares eletrônicos é o nome dado aos elétrons cedidos por cada um dos núcleos, figurando o compartilhamento dos elétrons das ligações covalentes.
Exemplo: H2O: H - O - H (molécula de água) formada por dois átomos de hidrogênio e um de oxigênio. Cada traço corresponde a um par de elétrons compartilhado formando uma molécula neutra, uma vez que não há perda nem ganho de elétrons nesse tipo de ligação.
Outros exemplos de substâncias formadas por ligações covalentes são:
- Gás oxigênio, O2
- Sacarose (açúcar de mesa), C12H22O11
- Ácido clorídrico, HCl
As ligações covalentes podem ser classificadas em polares ou apolares. No caso da água temos uma ligação covalente polar, pois os átomos que compõem a molécula apresentam diferentes eletronegatividades. Já o oxigênio (O2) apresenta uma ligação covalente apolar, pois é formado por átomos de um único elemento químico e, por isso, não apresenta diferença de eletronegatividade.
Saiba mais sobre as ligações covalentes.
Ligação Covalente Dativa
Também chamada de ligação coordenada, ocorre quando um dos átomos apresenta seu octeto completo, ou seja, oito elétrons na última camada e o outro, para completar sua estabilidade eletrônica, necessita adquirir mais dois elétrons.
Esse tipo de ligação é representada por uma seta e um exemplo é o composto dióxido de enxofre SO2: O = S → O.
Isso ocorre porque é estabelecida uma dupla ligação do enxofre com um dos oxigênios para atingir sua estabilidade eletrônica e, além disso, o enxofre doa um par de seus elétrons para o outro oxigênio para que ele fique com oito elétrons na sua camada de valência.
Saiba mais sobre a camada de valência.
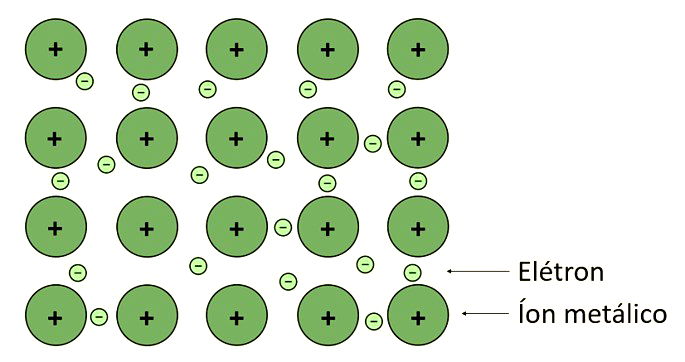
Ligação Metálica
É a ligação que ocorre entre os metais, elementos considerados eletropositivos e bons condutores térmico e elétrico. Para tanto, alguns metais perdem elétrons da sua última camada chamados de "elétrons livres" formando assim, os cátions.
A partir disso, os elétrons liberados na ligação metálica formam uma "nuvem eletrônica", também chamada de "mar de elétrons" que produz uma força fazendo com que os átomos do metal permaneçam unidos.
Exemplos de metais: Ouro (Au), Cobre (Cu), Prata (Ag), Ferro (Fe), Níquel (Ni), Alumínio (Al), Chumbo (Pb), Zinco (Zn), entre outros.
Os metais apresentam estado físico sólido em temperatura ambiente, com exceção do mercúrio, o único metal líquido nessas condições. As substâncias metálicas são boas condutoras de calor e eletricidade e, além disso, apresentam um brilho característico.
Sequência do diagrama de Pauling - distribuição eletrônica
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6
7s2 5f14 6d10 7p6
PESQUISE PARA RESPONDER:
Clique aqui Link para responder pelo formulário as questões
1-Qual a diferença entre fenômeno físico e fenômeno químico?
2-Dê dois exemplos de fenômeno físico e fenômeno químico.
3-O que é ferrugem ?
4-Como ocorre a ferrugem ?
5-O que é oxidação ?
6-O que são elétrons, prótons e nêutrons ?
7-O que são íons ?
8-O que são cátions e ânions ?
1o BIMESTRE
A tabela periódica em 3 D do Google link abaixo
Após anunciar o lançamento de atualizações destinadas a crianças e adolescentes, o Google lançou nesta quarta-feira (11) um novo recurso que deve ajudar a muitos estudantes: uma tabela periódica de elementos químicos interativa e em 3D, que facilita pesquisas de uma forma divertida.
A nova funcionalidade está sendo integrada ao dispositivo Google Nest Hub para incentivar alunos de química, mas já pode ser acessada em qualquer desktop ou celular através deste link. Como há uma infinidade de modelos de tabela periódica disponíveis na internet, o Google cuidou para que a sua fosse diferenciada, oferecendo alguns recursos extras.
Link da tabela periódica 3D
https://artsexperiments.withgoogle.com/periodic-table/
Tabela periódica atual com nomes dos elementos em português link abaixo
https://www.todamateria.com.br/tabela-periodica/
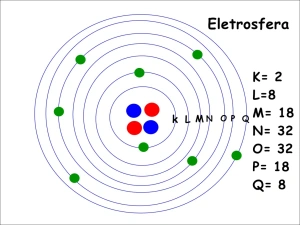
Eletrosfera e núcleo atômico
Exercícios referentes a massa atômica
E número atômico:
(FUCMT-MT) O íon de 11²³Na+ contém:
a)11 prótons, 11 elétrons e 11 nêutrons.
b)10 prótons, 11 elétrons e 12 nêutrons.
c)23 prótons, 10 elétrons e 12 nêutrons.
d)11 prótons, 10 elétrons e 12 nêutrons.
e)10 prótons, 10 elétrons e 23 nêutrons
Vídeos usados nas aulas de química:
Tema obtenção do etanol
Obtenção do álcool em gel
Tema destilação fracionada
Separação de misturas
Exemplos de misturas homogêneas e heterogêneas :
Floculação
Turmas de química trabalho de compensação de faltas
Alunos:
Kauã Correia da Silva 1A
Camila Regina 1A
Júlia Vitória 1A
Maria Vitória Cristiano 1A
Nicolas Gomes 1A
Caio Henrique 1B
Grazieli De Souza 1B
Isac de Lima 1B
Jean Borges 1B
Maryane Munhoz 1B
Sophia Tenório 1B
Alexandre Faustino 1C
Diego Raphael 1C
Eduarda Carvalho 1C
Eduardo da Silva 1C
Felipe Noim 1C
Gabriel Martins da Silva 1C
Jeniffer Claudia 1C
Kauã do Nascimento 1C
Matheus Alves 1C
Rafael Cajaiba 1C
Tales Morel 1C
Thiago Venancio 1C
Camilli Rodrigues 1D
Demétrius Gomes 1D
Évelyn Pereira 1D
Fabiane Mendes 1D
Gabriel Martins Alves 1D
Gustavo Arakaki 1D
Gustavo H. dos S. Pacheco 1D
Manuela Bittiner 1D
Maria Eduarda de Lima Teixeira 1D
Matheus Conrado 1D
Matheus Ferrari 1D
Tayne Rocha 1D
Vitória Mel 1D
Prof. Natalino disciplina Química 1º ano
O Brasil importa fertilizantes da Rússia, e com a guerra ocorrendo podemos ter certa escassez deste produto.
Faça um trabalho de pesquisa sobre os seguintes tópicos abaixo ( não é para responder como um questionário, tem que falar sobre o assunto):
Tópicos :
Para que servem os fertilizantes
Onde os fertilizantes são utilizados
Qual a composição química dos fertilizantes
Por que o Brasil não produz fertilizante suficiente
Se for impresso favor colocar no padrão Abnt
Pode ser manuscrito também.





Comentários
Postar um comentário